私たちの研究室で行われている研究内容をテーマごとにご紹介する前に、澱粉構造や代謝過程に関する基礎的な事項について説明します。必要のない方は飛ばしてくださって結構ですが、私たちの研究内容を本当に理解するためにはぜひ必要な知識です。
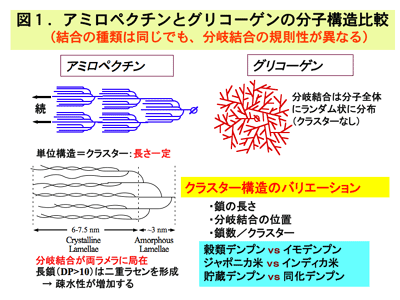
アミロペクチン分子は、クラスターと呼ばれる単位がタンデム状に連結した構造、いわゆるタンデム・クラスター構造をしているという特徴を持っています(図1)。これがまず、アミロペクチン分子のさまざまな構造変化(バリエーション)を理解し、これによって引き起こされる澱粉の性質への影響を考える際に最も重要なポイントです。クラスター内部は複数の分岐鎖から構成されていて、前または後のクラスターと連結している鎖は通常そのうちの1本と考えられています。クラスターの長さは植物種によらず、約9 nmとほぼ一定であるという法則性があります。クラスターの内部はさらにアモルファス・ラメラとクリスタル・ラメラと呼ばれる2つの領域に分けらます。前者はクラスター全体の還元末端部(前部)に位置し、分岐結合の密度(従ってαグルカン鎖の密度)が低い部分であり、後者はαグルカン鎖が密集している結晶性の高い領域で、分岐結合の位置も還元末端側に局在していると考えられます。側鎖の長さはグルコースの重合度(DP値 degree of polymerization)に比例することは当然ですが、重要なことは、隣り合う側鎖がともに DP 値が 10 以上の長さになると、自動的に1ピッチ当たり 6 グルコース残基(2.1 nm)から成る左巻きの2重ラセンが形成されるという性質があります。従ってクラスター全体では複数の2重ラセンが平行に並ぶのです。このクリスタル・ラメラで形成される2重ラセンがアミロペクチンの疎水性を画期的に高め、澱粉特有の結晶構造や機能特性・物性を大きく左右することになるのです。ラセンは結合力の弱い水素結合で形成されているので、高温になると2重ラセンはほどけますが、長さの長いラセンになればなるほどほどけにくく、疎水性が高くなります。この2重ラセンがクラスター内部で形成されていることが、澱粉が結晶性を持っていることの最大の原因になっているのです。
クラスター構造のバリエーションについて述べてみましょう。澱粉の性質が植物種や品種によって異なっており、その違いを生かしさまざまな食品や産業品の素材として選別して利用されていますが、相当部分がクラスター構造のバリエーションに起因していると私たちは予想しています。クラスターのサイズは一定ですから、クラスター構造のバリエーションは、
・クラスター当たりの鎖数(分岐結合数+1)
・構成鎖の鎖長
・分岐結合の位置
によって生ずると考えられます。
澱粉はさらに植物種や組織ごとに特有の形状とサイズを持つ澱粉粒を形成しているという特徴があります。澱粉粒は半結晶性を持っています。澱粉は水にさらすと沈殿する性質があり、縄文時代の昔から人々はこの性質を利用してトチやドングリの実から澱粉を精製していたのですが、水に溶けず沈殿するという澱粉粒の性質をたくみに利用していたのですね。しかし澱粉を水中で加熱すると、澱粉粒は膨潤するため粘性が急激に高まり糊状になります。さらに加熱すると粒が壊れ内部にパックされたアミロペクチン分子やアミロース分子が飛び出してきます。これを冷やすと、今度はアミロースやアミロペクチンの超長鎖などの長い鎖の部分同士が水素結合しあって不溶性の高分子が形成されます。この現象は一般に澱粉の老化と呼んでいます。冷めたご飯が硬くなるのはこのことが原因しています。このように、澱粉はただ温度処理することによって、溶けやすくなったり、ねばねばしてみたり、糊になったり、ふたたび硬くなったりと、他の物質にはない本当にユニークな性質があることがお分かりいただけたと思います。澱粉が示す特有の物性は、アミロペクチンやアミロースの分子構造に基づく要因と澱粉粒に基づく要因があることにも気づきますね。
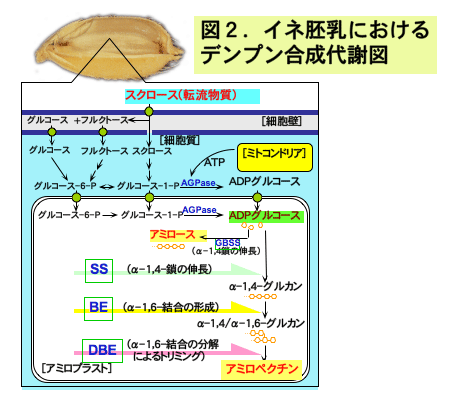
次に、澱粉合成に関与する酵素について見てみましょう。植物の澱粉合成には少なくとも 4 クラスの酵素[ADPグルコースピロフォスフォリラーゼ(ADPglucose pyrophosphorylase, AGPase;ADPグルコースの合成)、スターチシンターゼ(アミロペクチン合成に関わる可溶性の soluble starch synthase, SSと、アミロース合成に関わる澱粉粒に結合性の granule-bound starch synthase, GBSS;共にα-1,4 結合を伸長)、澱粉枝作り酵素(starch branching enzyme, BE;α-1,6 結合を形成)、澱粉枝切り酵素(starch debranching enzyme, DBE;α-1,6 結合を加水分解)]が関わっています(図2)。そして、各クラスの酵素には複数のサブユニットまたは複数のタイプのアイソザイムを有するのが植物の特徴です。グリコーゲンを合成する動物やバクテリアには基本的に各クラスには 1 種類の酵素(遺伝子)しかありませんし、DBE はグリコーゲン合成には関わらないと考えられています。私たちも個々のアイソザイムやサブユニットの機能を明らかにする研究を行ってきましたが、こうした研究を通じて、なぜ植物は複数のサブユニットやアイソザイムを持たなければ澱粉ができなかったのかも次第にわかってきました。
基礎学習はいったんここでとどめておき、以下に、個々の研究をご紹介します。