○イネの澱粉合成メカニズムの解明と新規澱粉の利用 |
 |
 |
・研究の概要
・イネ変異体の単離と解析
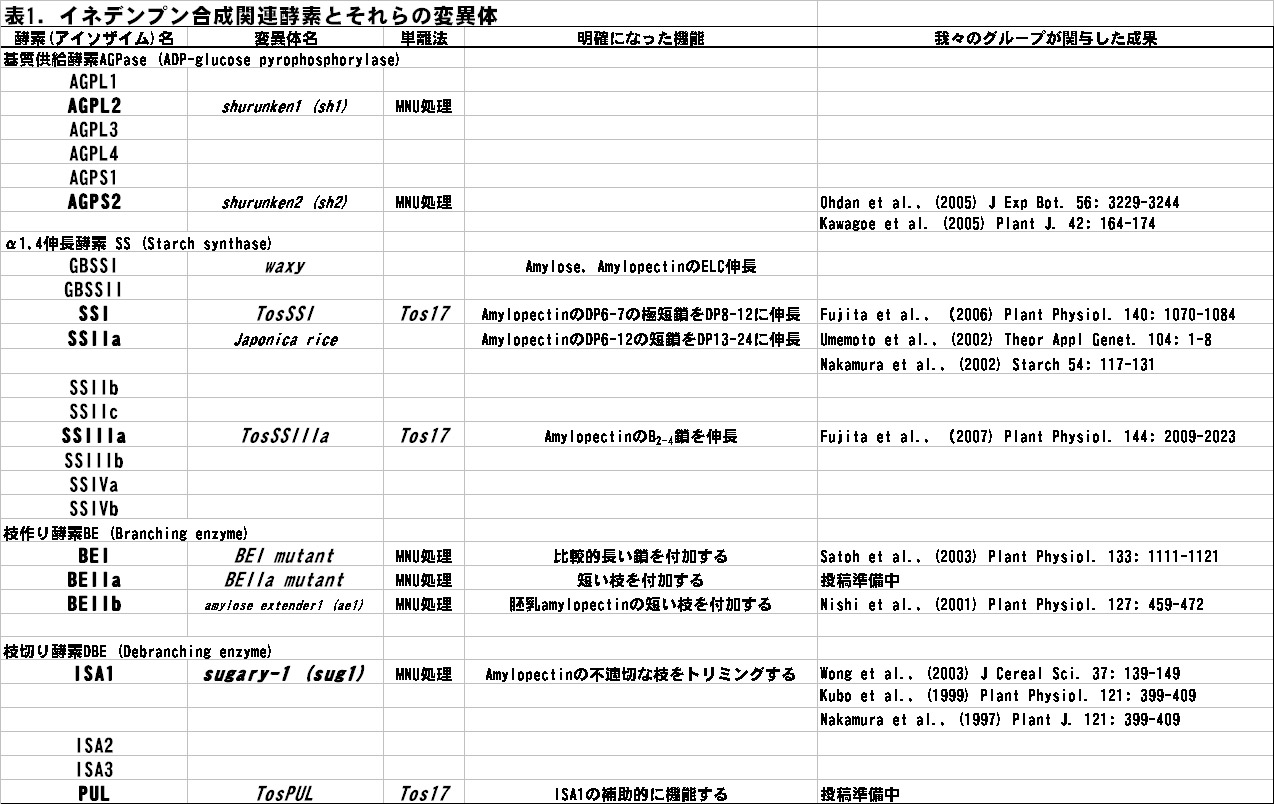
澱粉生合成メカニズムの解明には、変異体の利用が大変有効である。なぜなら、多くの場合、澱粉生合成に関与する特定のアイソザイム1つに変異が生じても致死にはならず、そのアイソザイムの欠失により澱粉の構造が変化し、欠失したアイソザイムの機能を推測することができるからである。また、これらの変異体は,ユニークな澱粉構造を示す変異体が多く、これらは、新規構造澱粉のとして、利用の面でも興味深い。我々のグループは、イネ変異体を用いることで、多数のアイソザイムが関与する澱粉生合成メカニズムにおける各々のアイソザイムの機能を解明してきた。表1は、これまで我々が使用してきた変異体の種類、作成方法、分かった機能(概要)、成果発表を示す。
(表はクリックすると拡大表示します。)
・Branching Enzyme (BE)の機能解明研究
・Starch synthase (SS)の機能解明研究
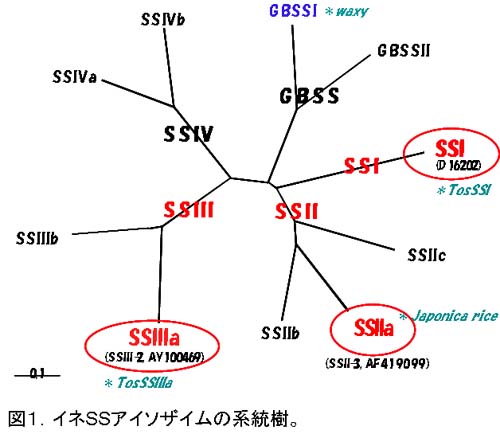
澱粉生合成に関与する酵素のうち、最も重要な酵素の一つがスターチシンターゼ(starch synthase, SS)である。この酵素は、ADP-glucoseを基質として、αグルカンプライマーの非還元末端にグルコースを付加することで、α1,4グルカン直鎖を伸長する酵素である。緑藻以上の植物には、多数のSSアイソザイムが存在し、イネには10種類のSSが存在する(図1:イネ10種類のSSアイソザイムの系統樹)。これらは、その一次構造からSSI, SSII, SSIII, SSIV, GBSSの5グループに明確に分類され、それぞれのアイソザイムの機能分化が、高等植物の種分化よりも古くから起きていたことを示す。
(図はクリックすると拡大表示します。)
10種類のアイソザイムの中で、最も古くからその変異体の存在が知られていたのは、waxy (wx)変異体であろう。この遺伝子が欠失すると、澱粉中のアミロースが欠失するため、主としてアミロース合成に関与することが多くの植物で知られている(ただし、アミロペクチンの超長鎖も伸長する)。GBSSグループの中のGBSSI遺伝子は、主として胚乳で発現し、GBSSII遺伝子は、葉身、果皮等の他の組織で発現することが知られている(Hirose & Terao, 2004; Ohdan et al., 2005)。それ以外のSSアイソザイムは、植物のさまざまな組織のアミロペクチン生合成に関与していると考えられている。
我々のグループは、アミロペクチン生合成に関与するSSアイソザイムのうち、胚乳で機能する重要な3種類(SSI, SSIIa, SSIIIa)について、これまで精力的に研究を行ってきた。
SSIの機能
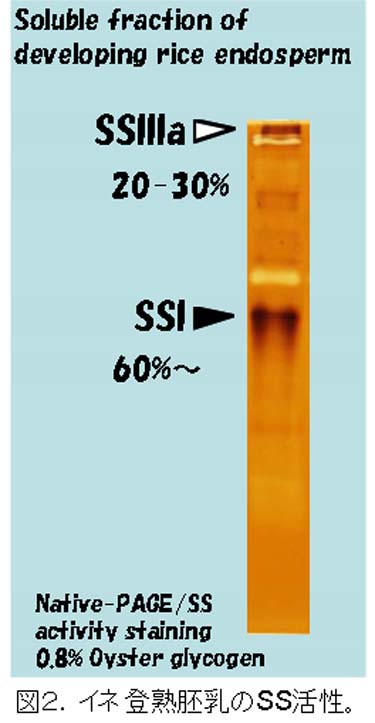
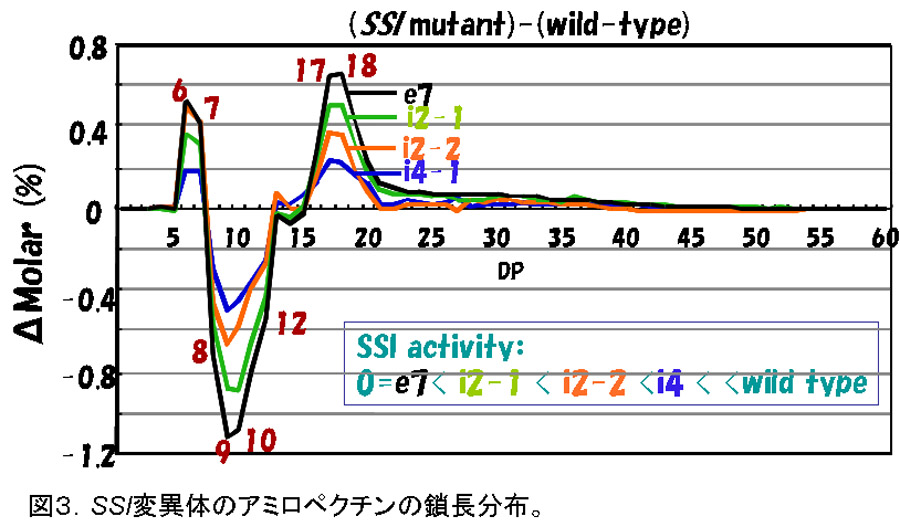
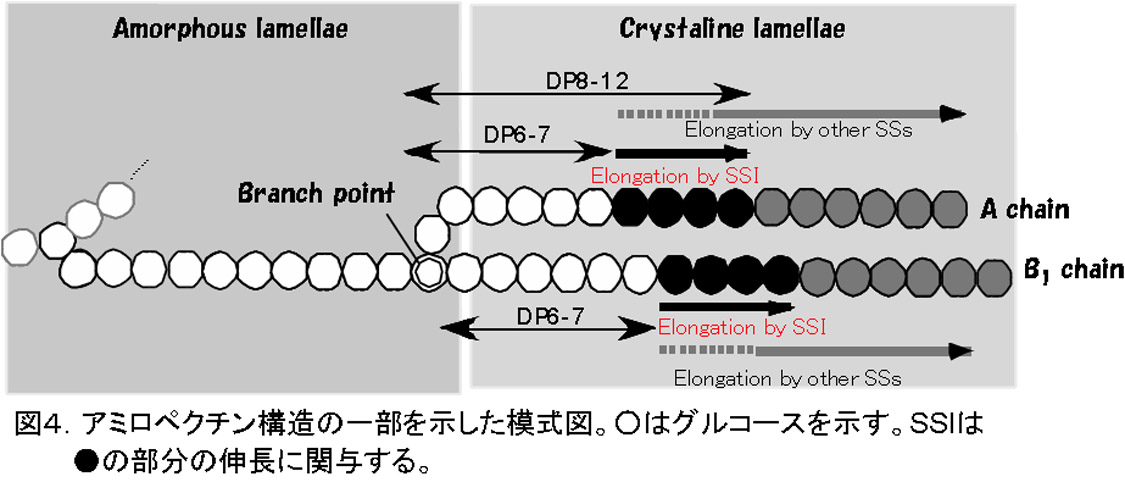
SSIの変異体は、ごく最近までいかなる植物でも単離されていなかった。イネの登熟胚乳の可溶性画分のSS活性の6割以上を占める(図2)SSIの変異体が見つからないのは、それが欠失した場合、致死になるからではないか、とまで考えられていた。我々は、レトロトランスポゾンであるTos17を用いた逆遺伝学的手法を用いて、貯蔵澱粉を蓄積する植物としては初めてSSI活性レベルの異なる4種類のSSI変異体を単離した(Fujita et al., 2006)。驚くことに、これらの変異体では、種子の形態、稔性や澱粉蓄積量は、全く正常であった。一方、アミロペクチンの鎖長分布を詳細に調べたところ、4種類の変異体のいずれでも同様の変化を示し、その変化の程度は、SSI活性レベルが低いほど、激しかった(図3)。つまり、これらの変化がSSI活性の低下から生じていることを示す。これらの鎖長分布の変化から、我々はSSIがアミロペクチンのDP6-7の非常に短い鎖を、少しだけDP8-12にまで伸長する機能を持つことを推測した(図4)。
SSIIの機能
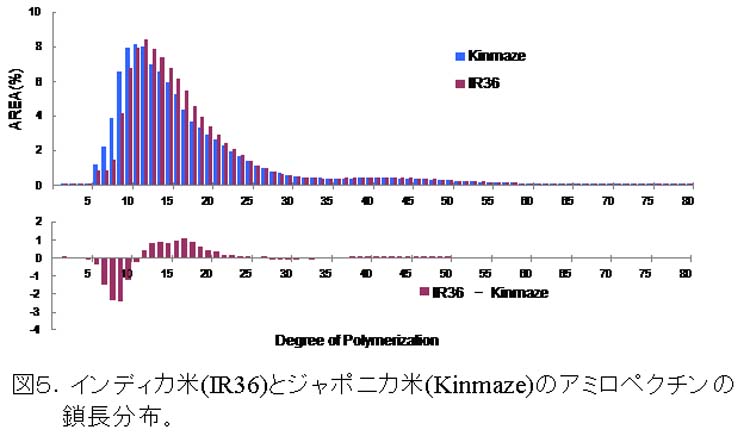
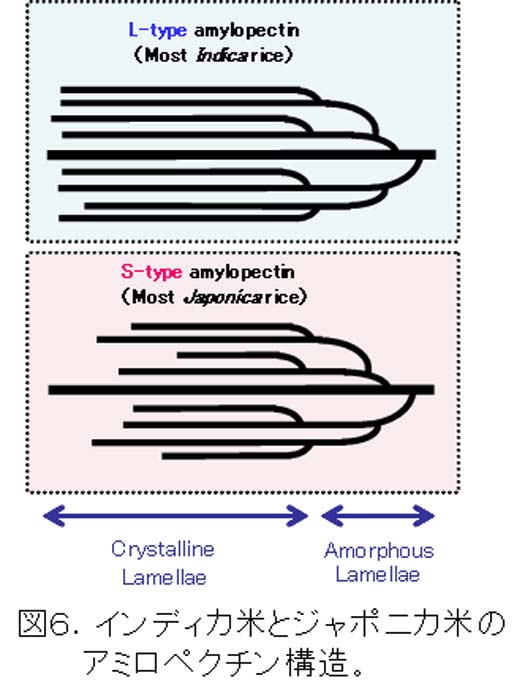
米にはその澱粉の性質が異なるインディカ米とジャポニカ米が存在する。これらは、アミロース含量が異なることでも知られているが、アミロペクチンの鎖長分布も全く異なることが明らかになった(図5、Nakamura et al., 2002)。即ち、ジャポニカ米のアミロペクチンは、短い鎖(S amylopectin)を多く持っており、インディカ米のそれは、比較的長い鎖(L amylopectin)を持っている(図6)。これらの原因酵素はSSIIaであることが明らかになった(Umemoto et al., 2002)。即ち、インディカ米が正常なSSIIa活性を持つのに対し、ジャポニカ米は、「SSIIa変異体」であるといえる。
SSIIIaの機能
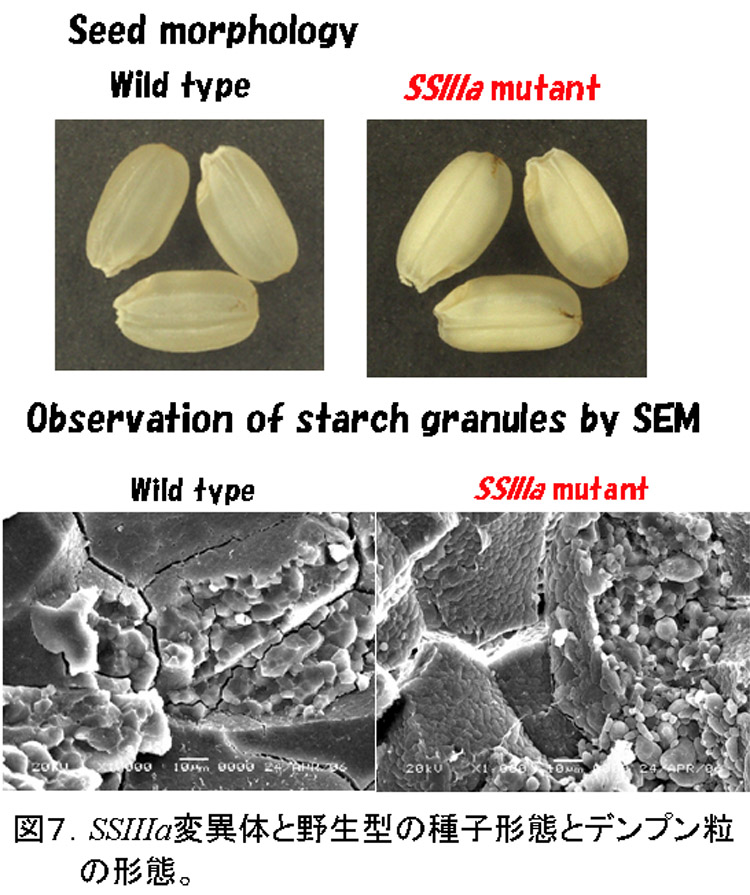
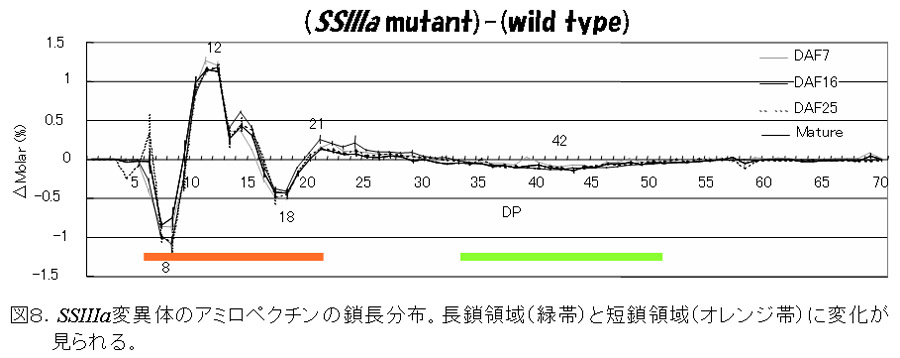
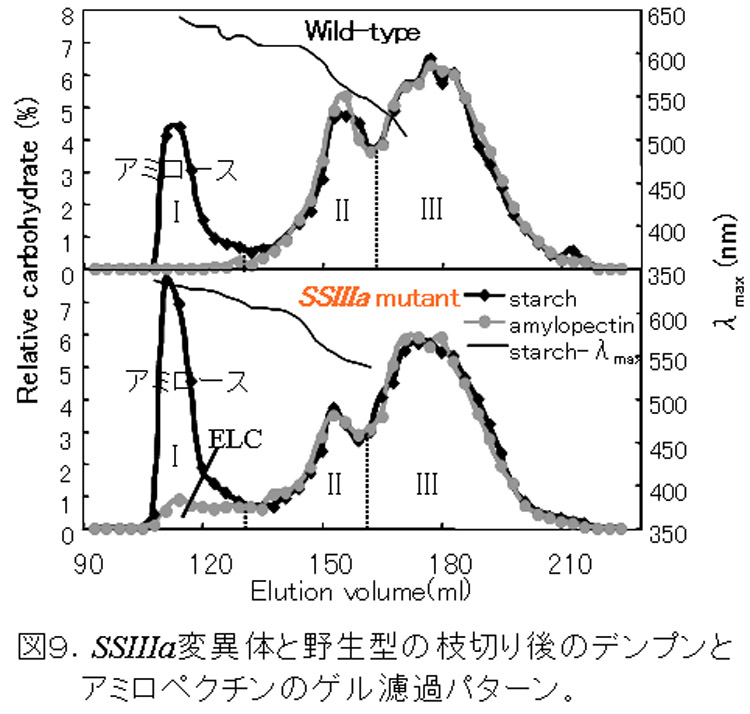
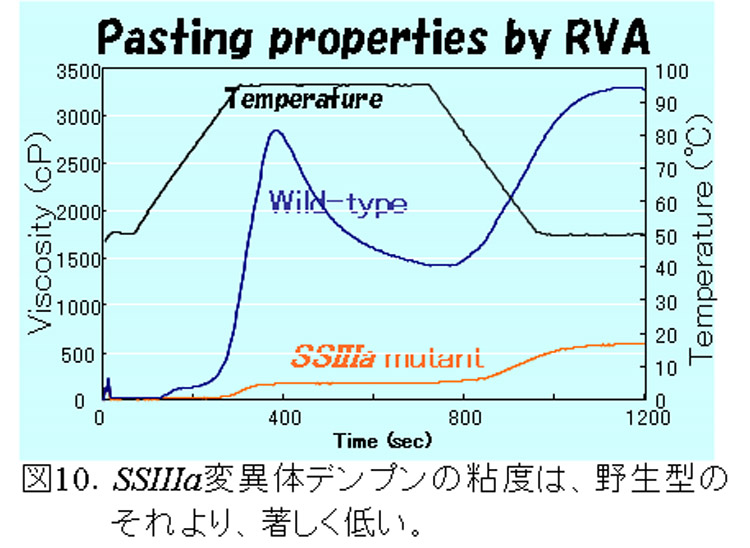
SSIIIaは、SSIに次いでイネ登熟胚乳の可溶性画分の約20-30%を占める(図2)主要なSSである。このアイソザイムの変異体は、トウモロコシのdull-1変異体が古くから知られていたが、イネでは単離されていなかった。我々は、SSI変異体を単離した方法と同様の方法で、SSIIIa変異体を単離した(Fujita et al., 2007)。この変異体は、種子が心白になり、澱粉粒は、丸い(図7)。アミロペクチンの鎖長分布は、DP40以上の長鎖が著しく減少しているため(図8)、SSIIIaの機能が、アミロペクチンのクラスター2個以上をつなぐ長い鎖を伸長すると推察できる。また、SSIIIaが欠失する代わりに、SSIとGBSSIの発現量が増加する(図9)ため、アミロペクチンの短鎖の鎖長分布が変化し(図8)、アミロース含量、アミロペクチンの超長鎖が増加した(図10)。これらの構造変化は、澱粉物性の劇的な変化(図11)の原因になっていると考えられる。
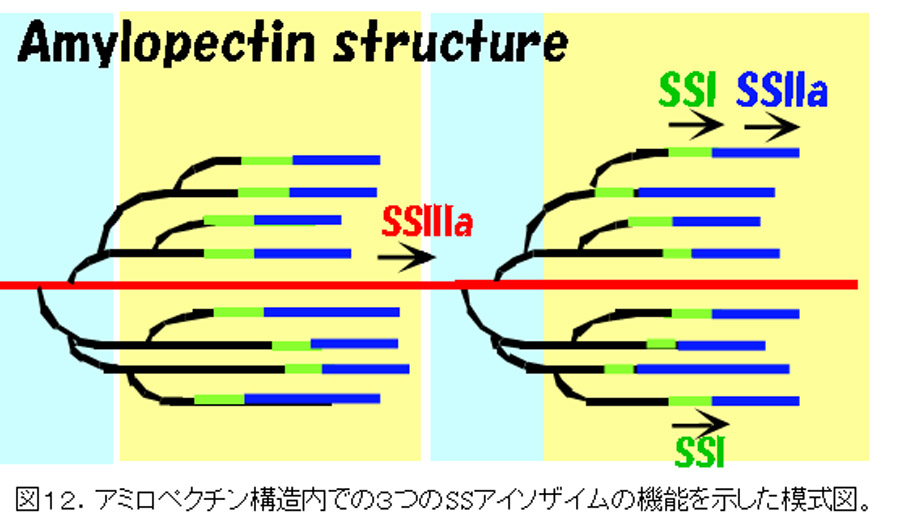
胚乳で発現する3つSSの機能
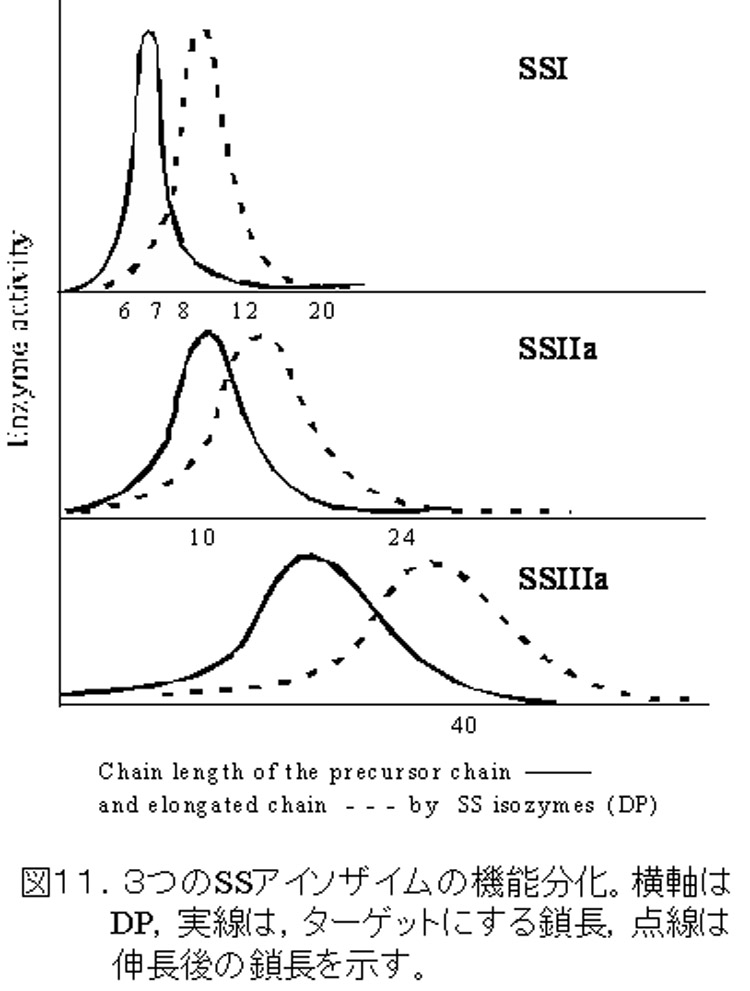
これまで述べてきたように,イネ胚乳のアミロペクチン生合成には,SSI,SSIIa, SSIIIaの3つが大きく関わっている。これらの機能解明から,明確な役割分担が推測される(図11,12)。即ち,SSIは,BEIIbが枝作りしたDP6-7の短い枝を少しだけ伸長してDP8-12にする機能を有し,SSIIaは,SSIが伸長したDP<12の鎖を12≦DP≦24に伸長する。SSIIIaは,アミロペクチンのクラスターとクラスターを連結しているような長い鎖(B2-4鎖)を伸長すると考えられる。強調したいのは,これらのいずれかが欠失しても,残っているいずれかのSS,あるいは,これ以外のSSがある程度は相補できるということである。図11のオーバーラップした部分は,それを意味している。しかし,他のアイソザイムによる相補は,‘完全’に欠失したアイソザイムの機能を相補できるわけではない。変異体が野生型とは異なるユニークな構造をもった澱粉を蓄積するのは,そのためである。
・Debranching enzyme (DBE)の機能解明研究
・アミロペクチンの合成モデル
○バイオテクノロジーによる新規澱粉の作成 |
 |
 |
・研究の概要
・イネアミロペクチンエンジニアリングの試み:クラスターワールド
・SS遺伝子制御
・BE遺伝子制御
・DBE遺伝子制御

